Seperti yang kita ketahui bahwa banyak sekali jenis senyawa kimia di sekitar kita, bahkan masih ada banyak juga yang belum teridentifikasi. Termasuk senyawa dengan jenis hidrokarbon yang memiliki jenis olefin.
Lalu, apa hubungannya dengan topik yang kita bahas saat ini? Jadi Olefin adalah salah satu jenis dari hidrokarbon yang merupakan senyawa kimia organik. Tidak perlu bertele-tele lagi, mari kita simak bersama apa itu olefin.
Apa itu Olefin?
Jadi, apa itu olefin? Seperti yang sudah tersebut sekilas olefin adalah kelompok hidrokarbon yang memiliki ikatan ganda, sehingga tergolong sebagai hidrokarbon tidak jenuh. Nama lain dari olefin adalah alkena.
Alkena merupakan senyawa karbon yang bersifat tidak jenuh dan memiliki setidaknya satu ikatan ganda, yaitu C-C. Dalam senyawa ini, jumlah unsur karbon (C) sama dengan senyawa alkana, tetapi unsur hidrogen (H) pada senyawa alkena memiliki jumlah yang lebih sedikit. Rumus umum untuk senyawa alkena adalah C2H2n.
Kegunaan Olefin

Tidak dapat terpungkiri bahwa senyawa alkena juga memiliki peran yang penting dalam industri kimia, terutama sebagai bahan baku untuk produksi plastik, bahan kimia, dan aditif. Agar lebih jelas, berikut kegunaan olefin adalah antara lain:
1. Polietilena sebagai Plastik Multifungsi
Kegunaan olefin pertama adalah polietilena. Polietilena adalah jenis plastik yang paling banyak di dunia. Plastik ini berfungsi dalam berbagai aplikasi kehidupan sehari-hari, seperti kantong plastik dan pembungkus.
Selain itu, polietilena juga dapat mengandung berbagai tambahan seperti pengisi, plasticizer, dan pewarna.
2. PVC (Polivinilklorida) untuk Konstruksi dan Perekat
PVC adalah plastik yang banyak berguna dalam pembuatan pipa paralon dan pelapis lantai. Material ini memiliki berbagai kegunaan dalam industri konstruksi dan sebagai perekat.
3. Etanol
Kegunaan olefin selanjutnya adalah etanol. Etanol, dengan nama sebutan lain alkohol, berfungsi sebagai bahan bakar dan sebagai bahan antara dalam pembuatan berbagai produk, termasuk asam asetat.
4. Etilena Glikol untuk Penangkal Beku yang Efektif
Etilena glikol, atau glikol, berfungsi sebagai bahan antibeku yang berguna dalam radiator mobil, terutama di daerah dengan iklim dingin.
5. Polipropilena sebagai Alternatif untuk Plastik Multifungsi
Kegunaan olefin selanjutnya adalah polipropilena. Polipropilena berfungsi untuk membuat karung plastik dan tali plastik. Bahan ini terkenal lebih kuat daripada dengan polietilena.
6. Gliserol untuk Bahan Multifungsi dalam Industri Petrokimia
Gliserol berfungsi dalam berbagai industri, termasuk kosmetik sebagai pelembab, dalam industri makan, dan juga dalam pembuatan bahan peledak seperti nitrogliserin.
7. Isopropil Alkohol untuk Bahan Dasar untuk Pembuatan Aseton
Isopropil alkohol berfungsi sebagai bahan dasar dalam produksi berbagai produk petrokimia lainnya, termasuk aseton.
Struktur Olefin
Olefin, adalah jenis senyawa yang hidrokarbon tak jenuh dan memiliki satu atau lebih ikatan ganda karbon-karbon (C=C) dalam strukturnya.
Struktur olefin yang paling umum adalah memiliki rumus umum C2H2n, di mana n adalah jumlah atom karbon dalam rantai.
Hal ini menunjukkan bahwa untuk setiap atom karbon ada dua atom hidrogen yang terikat, kurang dari jumlah hidrogen yang ada dalam alkana yang memiliki rumus C2H2n+2.
Berikut ini penjelasan sekilas tentang struktur olefin adalah antara lain:
1. Ikatan
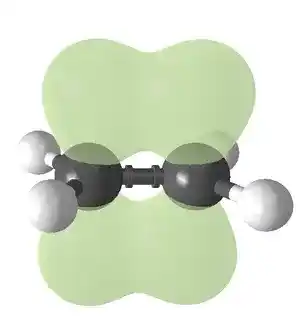
Seperti halnya ikatan kovalen tunggal, ikatan rangkap dapat divisualisasikan melalui tumpang tindih orbital atom. Namun, berbeda dengan ikatan tunggal yang hanya memiliki satu ikatan sigma, ikatan rangkap karbon-karbon terdiri dari satu ikatan sigma dan satu ikatan pi.
Ikatan rangkap ini lebih kuat dibandingkan dengan ikatan kovalen tunggal (611 kJ/mol untuk C=C dibandingkan dengan 347 kJ/mol untuk C–C) dan memiliki panjang rata-rata 1,33 Ångström (133 pm).
Setiap atom karbon dalam ikatan rangkap memanfaatkan tiga orbital hibrida sp² untuk membentuk ikatan sigma dengan tiga atom lainnya (satu atom karbon dan dua atom hidrogen).
Orbital atom 2p yang tidak terlibat dalam hibridisasi, yang tegak lurus terhadap bidang yang dibentuk oleh ketiga orbital hibrida sp², akan berkontribusi dalam pembentukan ikatan pi.
Ikatan ini berada di luar sumbu utama C–C, dengan separuh ikatan terletak di satu sisi molekul dan separuh lainnya di sisi yang berlawanan.
Rotasi di sekitar ikatan rangkap karbon-karbon sulit dilakukan karena memerlukan energi besar untuk memutus kesejajaran orbital p pada dua atom karbon. Akibatnya, alkena dengan substituen membentuk dua isomer, yaitu isomer cis dan trans.
Alkena yang lebih kompleks dapat diberi nama menggunakan notasi E–Z untuk molekul dengan tiga atau empat substituen yang berbeda.
Sebagai contoh, isomer butena, (Z)-but-2-ena (alias cis-2-butena) memiliki dua grup metil yang berada di sisi yang sama dari ikatan rangkap, sedangkan (E)-but-2-ena (alias trans-2-butena) memiliki grup metil di sisi yang berlawanan. Kedua isomer butena ini menunjukkan perbedaan yang kecil dalam sifat kimia dan fisiknya.
Rotasi sebesar 90° dari ikatan C=C (yang dapat ditentukan oleh posisi gugus fungsi yang terikat pada karbon) memerlukan lebih sedikit energi dibandingkan dengan kekuatan ikatan pi, sehingga ikatan tersebut tetap terjaga.
Pemahaman umum dalam buku teks menyatakan bahwa orbital p tidak dapat mempertahankan ikatan seperti itu. Namun, penyimpangan orbital p sebenarnya lebih kecil dari perkiraannya karena adanya piramidalisasi.
trans-Siklooktena adalah alkena linier yang stabil, dengan penyimpangan orbital sebesar 19° dan sudut dihedral 137° (normal 120°), serta tingkat piramidalisasi 18°. Isomer trans sikloheptena hanya dapat bertahan pada suhu rendah.
2. Bentuk
Sesuai dengan perkiraan model repulsi pasangan elektron VSEPR, geometri molekul senyawa alkena memiliki sudut ikatan di sekitar masing-masing karbon dalam ikatan rangkap yang berkisar sekitar 120°.
Sudut ini dapat bervariasi akibat interaksi sterik antara gugus fungsi yang terikat pada karbon dalam ikatan rangkap. Misalnya, sudut ikatan C-C-C pada propilena adalah 123,9°.
Dalam hal alkena berjembatan, aturan Bredt menegaskan bahwa ikatan rangkap tidak dapat terbentuk di pangkal jembatan dari sistem cincin kecuali jika cincinnya cukup besar (delapan atom atau lebih).
3. Sifat Fisika
Sifat fisika alkena mirip dengan alkana. Mereka tidak memiliki warna, bersifat nonpolar, mudah terbakar, dan hampir tidak mengeluarkan bau.
Perbedaan utama di antara keduanya adalah alkena memiliki tingkat keasaman yang jauh lebih tinggi daripada alkana. Bentuk fisik alkena bergantung pada massa molekulnya.
Tiga alkena paling sederhana yaitu etena, propena, dan butena berupa gas. Alkena linier yang memiliki 5 hingga 16 atom karbon berada dalam bentuk cair, sementara alkena dengan lebih dari 15 atom karbon berbentuk padat.
3. Reaksi
Olefin adalah senyawa yang relatif stabil, tetapi lebih reaktif daripada alkana. Penyebabnya adalah baik oleh reaktivitas ikatan pi karbon-karbon maupun keberadaan pusar CH alilik. Sebagian besar reaksi alkena melibatkan adisi pada ikatan pi, yang akan membentuk ikatan tunggal baru.
Alkena berperan sebagai bahan baku dalam industri petrokimia karena mereka dapat terlibat dalam berbagai reaksi, terutama dalam polimerisasi dan alkilasi.
Contoh Alkena
Berikut adalah beberapa contoh senyawa alkena.
1. Etena
Contoh alkena pertama adalah etena yang merupakan senyawa alkena paling sederhana. Biasanya berguna dalam produksi plastik, seperti polietilen. Memiliki rumus C2H4 dan struktur H2C=CH2.
2. Propena (Propylene)
Contoh alkena kedua adalah propena yang biasa berfungsi dalam produksi polipropilen dan sebagai bahan baku dalam sintesis bahan kimia. Memiliki rumus C3H6 dan struktur H2C=CH-CH3
3. Butena (Butylene)
Contoh alkena selanjutnya adalah butena yang biasa digunakan dalam produksi bahan kimia dan polimer. Memiliki rumus C4H8 dan isomer berikut ini:
- 1-Butena: H2C=CH-CH2-CH3
- 2-Butena: CH3-CH=CH-CH3
4. Pentena (Pentylen)
Contoh alkena selanjutnya adalah pentena yang biasa digunakan dalam sintesis organik. Memiliki rumus C5H10 dan isomer berikut ini:
- 1-Petena: H2C=CH-CH2-CH3
- 2-Petena: CH3-CH=CH-CH2-CH3
5. Heksena (Hexene)
Contoh alkena kelima adalah heksena yang digunakan dalam produksi plastik dan senyawa kimia. Contoh yang satu ini memiliki rumus C6H12 dan isomer berikut ini:
- 1-Heksena: H2C=CH-CH2-CH2-CH2-CH3
- 2-Heksena: CH3-CH=CH-CH2-CH2-CH3
6. Sikloheksena (Cyclohexene)
Contoh selanjutnya adalah sikloheksena yang digunakan dalam sintesis organik dan sebagai pelarut. Senyawa ini memiliki rumus C6H10.
7. Oktadiena (Octadiene)
Merupakan senyawa organik yang mudah terbakar dan memiliki rumus kimia C8H14. Oktadiena tergolong senyawa oktana yang memiliki dua ikatan rangkap pada posisi 1 dan 7.
Penutup
Demikianlah artikel kali ini yang membahas tentang olefin atau alkena. Dapat kita ambil kesimpulan bahwa olefin adalah kelompok hidrokarbon tak jenuh yang memiliki ikatan ganda antara atom karbon.
Dengan rumus umum C2H2n, olefin digunakan dalam berbagai industri, termasuk produksi plastik seperti polietilena dan polipropilena, serta bahan kimia penting seperti etanol dan etilena glikol.
Struktur dan sifat fisika olefin mirip dengan alkana, tetapi olefin lebih reaktif karena ikatan rangkapnya. Olefin memainkan peran penting dalam petrokimia, terutama dalam proses polimerisasi untuk menghasilkan berbagai produk komersial.
Terakhir, petrokimia adalah senyawa kimia hasil dari minyak bumi atau gas alam yang nanti pengolahanny akan menjadi bahan bakar. Jika Anda mencari bahan bakar yang memiliki kualitas baik, percayakan Megah Anugerah Energi.
Jika Anda tertarik untuk membelinya atau sekedar bertanya tentang kebutuhan Anda segera hubungi kontak kami.






